Ikatan kimia adalah salah satu konsep mendasar dalam kimia yang membantu kita memahami bagaimana atom-atom dapat bergabung untuk membentuk senyawa atau molekul kimia. Konsep ini menjelaskan gaya yang menjaga atom-atom tersebut tetap bersama dalam sebuah senyawa yang dihasilkan. Dengan kata lain, ikatan kimia adalah fenomena yang memungkinkan dua atau lebih unsur bergabung menjadi sebuah senyawa dengan aturan tertentu. Dalam artikel ini, kita akan menjelaskan ikatan kimia secara mendalam, termasuk jenis-jenisnya, kekuatan, dan sifat-sifatnya.
Jenis Ikatan Kimia
Ikatan kimia dapat dibagi menjadi empat jenis utama, yaitu:
- Ikatan Ion
- Ikatan Kovalen
- Ikatan Kovalen Koordinat
- Ikatan Logam
Mari kita bahas masing-masing jenis ikatan ini secara lebih rinci.
1. Ikatan Ion
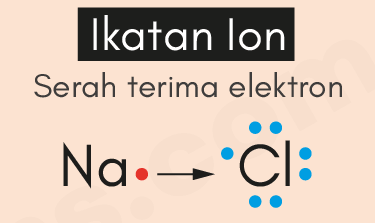
Ikatan ion adalah jenis ikatan kimia yang terjadi karena adanya gaya tarik-menarik elektrostatis antara ion positif dan ion negatif dalam suatu senyawa kimia. Ikatan ini terjadi antara atom-atom yang memiliki perbedaan elektronegativitas yang signifikan. Elektronegativitas adalah kemampuan suatu atom untuk menarik elektron dari atom lain. Ketika atom yang lebih elektronegatif menarik elektron dari atom yang kurang elektronegatif, atom yang lebih elektronegatif akan menjadi ion negatif, sementara atom yang kurang elektronegatif akan menjadi ion positif.
Contoh ikatan ion yang paling umum adalah natrium klorida (NaCl), yang lebih dikenal sebagai garam dapur. Atom natrium (Na) memiliki elektronegativitas sekitar 0,9, sementara atom klor (Cl) memiliki elektronegativitas sekitar 3,0. Perbedaan elektronegativitas yang signifikan ini mengakibatkan atom natrium melepaskan satu elektronnya kepada atom klor. Akibatnya, atom natrium menjadi ion positif (Na+), dan atom klor menjadi ion negatif (Cl-). Ikatan ion ini terjadi karena tarikan elektrostatis antara ion Na+ dan ion Cl-.
2. Ikatan Kovalen
Ikatan kovalen adalah jenis ikatan kimia yang terjadi ketika dua atom berbagi pasangan elektron untuk mencapai konfigurasi elektron gas mulia. Konfigurasi elektron gas mulia adalah keadaan di mana atom memiliki delapan elektron di kulit valensinya, kecuali hidrogen dan helium, yang hanya memiliki dua elektron di kulit valensinya.
Ikatan kovalen dapat dibagi menjadi dua jenis:
1. Ikatan Kovalen Tunggal
Terjadi ketika dua atom berbagi satu pasangan elektron. Ini adalah jenis ikatan kovalen paling sederhana.
2. Ikatan Kovalen Rangkap
Terjadi ketika dua atom berbagi dua pasangan elektron.
Contoh ikatan kovalen tunggal adalah molekul hidrogen (H2), di mana dua atom hidrogen berbagi satu pasangan elektron. Demikian juga, oksigen (O2) adalah contoh ikatan kovalen rangkap, di mana dua atom oksigen berbagi dua pasangan elektron.
3. Ikatan Kovalen Koordinat
Ikatan kovalen koordinat adalah jenis ikatan kovalen yang terjadi ketika pasangan elektron yang digunakan untuk berikatan disumbangkan oleh salah satu atom saja. Atom yang menyumbangkan pasangan elektron disebut donor, sedangkan atom yang menerima pasangan elektron disebut akseptor.
Contoh ikatan kovalen koordinat adalah amonia (NH3). Atom nitrogen (N) dalam amonia menyumbangkan sepasang elektron untuk membentuk ikatan kovalen dengan tiga atom hidrogen (H). Ini menciptakan molekul amonia yang memiliki bentuk piramida trigonal.
Baca Juga
4. Ikatan Logam
Ikatan logam adalah jenis ikatan kimia yang terjadi antara ion-ion logam yang terikat bersama oleh lautan elektron. Ini menghasilkan struktur yang khas dalam logam, di mana inti-ion positif dari atom logam tertentu dikelilingi oleh awan elektron yang bergerak bebas. Ikatan ini terjadi karena adanya gaya tarik-menarik antara muatan positif ion-ion logam dan elektron-elektron yang bergerak bebas.
Contoh ikatan logam termasuk besi, emas, tembaga, dan sebagian besar unsur logam lainnya. Dalam ikatan logam, elektron bebas ini memungkinkan konduktivitas panas dan listrik yang tinggi, sehingga logam memiliki sifat-sifat yang unik.
Faktor-Faktor yang Mempengaruhi Kekuatan Ikatan Kimia
Kekuatan ikatan kimia ditentukan oleh beberapa faktor utama:
1. Jumlah Pasangan Elektron yang Digunakan untuk Berikatan
Ikatan yang melibatkan lebih banyak pasangan elektron akan cenderung lebih kuat daripada ikatan yang melibatkan lebih sedikit pasangan elektron. Sebagai contoh, ikatan ganda (dua pasangan elektron) dalam ikatan rangkap kovalen lebih kuat daripada ikatan tunggal (satu pasangan elektron).
2. Perbedaan Elektronegativitas Atom-atom yang Berikatan
Perbedaan elektronegativitas antara atom-atom yang berikatan memengaruhi kekuatan ikatan kimia. Semakin besar perbedaan elektronegativitas, semakin kuat ikatan ion atau ikatan kovalen polar yang terbentuk. Atom-atom dengan perbedaan elektronegativitas yang besar akan menarik elektron lebih kuat, sehingga ikatan akan menjadi lebih kuat.
3. Bentuk Geometri Molekul
Bentuk geometri molekul juga berpengaruh terhadap kekuatan ikatan kimia. Ikatan yang memiliki bentuk geometri molekul yang teratur dan simetris cenderung lebih kuat daripada ikatan dengan bentuk geometri yang tidak teratur. Ini terkait dengan distribusi pasangan elektron dalam molekul.
Sifat-Sifat Ikatan Kimia
Selain kekuatan, ikatan kimia juga memiliki berbagai sifat yang memengaruhi karakteristik senyawa atau molekul yang terbentuk. Beberapa sifat ini meliputi:
Sifat Fisis:
1. Titik Leleh dan Titik Didih
Titik leleh adalah suhu di mana suatu senyawa padat menjadi cair, sedangkan titik didih adalah suhu di mana senyawa cair menjadi gas. Ikatan yang lebih kuat cenderung memiliki titik leleh dan titik didih yang lebih tinggi.
2. Massa Jenis
Massa jenis mengacu pada massa suatu benda per volume tertentu. Ikatan yang lebih kuat seringkali menghasilkan senyawa dengan massa jenis yang lebih tinggi.
3. Kekerasan
Kekerasan adalah kemampuan suatu bahan untuk menahan deformasi atau perubahan bentuk. Logam, yang memiliki ikatan logam, biasanya memiliki sifat kekerasan yang tinggi.
4. Kerapatan
Kerapatan adalah jumlah massa per unit volume. Senyawa dengan ikatan yang lebih kuat cenderung memiliki kerapatan yang lebih tinggi.
Sifat Kimia:
1. Kereaktifan
Kereaktifan mengacu pada sejauh mana suatu senyawa cenderung berpartisipasi dalam reaksi kimia. Senyawa dengan ikatan yang mudah terputus atau pecah cenderung lebih reaktif.
2. Larutan
Beberapa senyawa lebih larut dalam air daripada yang lain, tergantung pada tipe ikatan yang terbentuk. Ikatan ion dan ikatan kovalen polar cenderung lebih larut dalam air.
3. Pembentukan Senyawa
Sifat kimia ikatan kimia memengaruhi kemampuan suatu senyawa untuk berikatan dengan unsur atau molekul lain, membentuk senyawa yang berbeda.
Kesimpulan
Ikatan kimia adalah dasar dari berbagai senyawa dan molekul yang kita temui dalam kehidupan sehari-hari. Dalam kimia, kita mengenal empat jenis utama ikatan kimia: ikatan ion, ikatan kovalen, ikatan kovalen koordinat, dan ikatan logam. Kekuatan ikatan ini dipengaruhi oleh faktor seperti jumlah pasangan elektron yang digunakan, perbedaan elektronegativitas atom, dan bentuk geometri molekul. Sifat-sifat ikatan kimia mencakup aspek fisik seperti titik leleh, massa jenis, dan kekerasan, serta aspek kimia seperti kereaktifan, larutan, dan kemampuan untuk membentuk senyawa lain.
Dengan pemahaman yang lebih mendalam tentang ikatan kimia, kita dapat menjelaskan mengapa senyawa-senyawa tertentu memiliki sifat-sifat tertentu, dan bagaimana senyawa-senyawa ini berinteraksi dalam berbagai reaksi kimia. Ini adalah landasan yang penting dalam memahami kimia dan aplikasinya dalam berbagai bidang, seperti ilmu material, kedokteran, dan teknologi. Semakin dalam pemahaman kita tentang ikatan kimia, semakin besar juga kemampuan kita untuk merancang senyawa-senyawa baru dengan sifat-sifat yang diinginkan.