Dalam dunia kimia, pengelompokan unsur merupakan salah satu langkah penting dalam memahami perilaku unsur-unsur kimia. Selama berabad-abad, para ilmuwan telah berusaha untuk mengelompokkan unsur-unsur berdasarkan sifat-sifat mereka. Artikel ini akan mengulas sejarah pengelompokan unsur-unsur dari hukum-hukum awal seperti Hukum Triade Dobereiner hingga perkembangan terkini dalam Tabel Periodik Modern.
1. Pengelompokan Unsur Berdasarkan Logam dan Non-Logam
Salah satu cara awal untuk mengelompokkan unsur-unsur adalah berdasarkan klasifikasi dasar sebagai logam dan non-logam. Meskipun pengelompokan ini merupakan dasar, kita sekarang tahu bahwa dalam berbagai unsur logam maupun non-logam, masih terdapat variasi besar dalam sifat-sifat unsur-unsur.
2. Hukum Triade Dobereiner
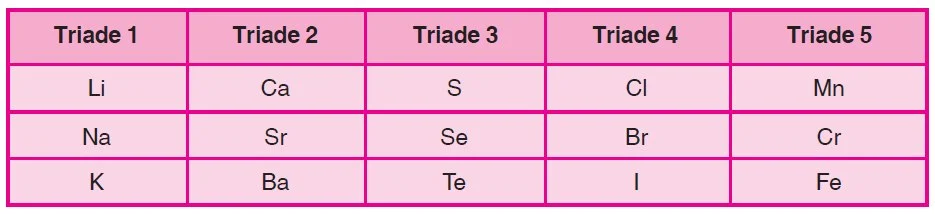
Pada tahun 1829, Johan Wolfgang Dobereiner menciptakan pendekatan awal dalam pengelompokan unsur. Ia mengamati bahwa beberapa unsur memiliki kemiripan sifat dan mengelompokkannya menjadi "Triade." Setiap Triade terdiri dari tiga unsur, dan ketika diurutkan berdasarkan kenaikan massa atom, ternyata massa atom dan sifat-sifat unsur kedua merupakan rata-rata dari unsur pertama dan ketiga dalam Triade tersebut. Walaupun ini adalah langkah penting dalam pengelompokan unsur, metode ini memiliki kelemahan karena tidak semua kelompok terdiri dari hanya tiga unsur.
Contoh Hukum Triade Dobereiner
Hukum Triade Dobereiner adalah salah satu konsep awal dalam pengelompokan unsur yang dikemukakan oleh Johan Wolfgang Dobereiner pada tahun 1829. Konsep ini mengeksplorasi kemiripan sifat-sifat kimia antara tiga unsur yang dianggap serupa. Salah satu contoh yang paling terkenal adalah Triade Dobereiner yang melibatkan unsur klor (Cl), bromin (Br), dan iodin (I).
Dalam Triade ini, Dobereiner mengamati bahwa unsur-unsur tersebut memiliki sifat-sifat yang mirip, dan keduanya dapat digabungkan untuk menghasilkan nilai rata-rata. Dalam kasus Triade ini, massa atom bromin (Br) adalah rata-rata dari massa atom klor (Cl) dan iodin (I). Berikut adalah ilustrasi dari Triade Dobereiner ini:
Triade Dobereiner: Klor, Bromin, dan Iodin
- Klor (Cl) memiliki massa atom sekitar 35.5.
- Bromin (Br) memiliki massa atom sekitar 80.
- Iodin (I) memiliki massa atom sekitar 127.
Jika kita mengambil rata-rata dari massa atom klor dan iodin:
(35.5 + 127) / 2 = 81.25
Hasilnya adalah 81.25, yang cukup mendekati massa atom bromin (80). Dalam Triade Dobereiner ini, Dobereiner telah mengidentifikasi pola bahwa massa atom unsur di tengah dalam Triade tersebut adalah rata-rata dari massa atom unsur di sekitarnya, dan ini menciptakan pengelompokan unsur dengan sifat-sifat yang mirip.
Bunyi Hukum Triade Dobereiner
Jika tiga unsur di dalam triade disusun menurut kenaikan massa atomnya, massa atom unsur di tengah (ke-2) sama dengan massa atom rata-rata unsur ke-1 dan ke-3.
Kelemahan Hukum Triade Dobereiner
Namun, Hukum Triade Dobereiner memiliki kelemahan, yaitu tidak semua unsur dapat digolongkan dalam kelompok tiga seperti ini, dan tidak semua unsur menunjukkan pola yang sama. Seiring berjalannya waktu, pengelompokan unsur berdasarkan triade ini digantikan oleh metode yang lebih sistematis dan komprehensif seperti Tabel Periodik yang dikembangkan kemudian oleh Dmitri Mendeleev dan Tabel Periodik Modern.
3. Hukum Oktaf Newlands
Hukum Oktaf Newlands adalah salah satu konsep awal dalam pengelompokan unsur yang dikemukakan oleh A.R. Newlands pada tahun 1864. Konsep ini mencoba mengidentifikasi kemiripan sifat-sifat kimia antara unsur-unsur berdasarkan kenaikan massa atom relatifnya. Hukum Oktaf Newlands menyatakan bahwa unsur-unsur yang berselisih satu oktaf dalam kenaikan nomor atom (misalnya unsur nomor 1 dengan nomor 8, unsur nomor 2 dengan nomor 9, dan seterusnya) menunjukkan kemiripan sifat atau perubahan sifat yang teratur.
Bunyi Hukum Oktaf Newlands
Jika unsur-unsur disusun berdasarkan kenaikan massa atom maka sifat unsur
tersebut akan berulang setelah unsur kedelapan.
Contoh Penerapan Hukum Oktaf Newlands
Salah satu contoh penerapan Hukum Oktaf Newlands adalah dengan mengamati unsur-unsur dalam golongan yang berdekatan dalam Tabel Periodik. Misalnya, Newlands mengidentifikasi bahwa unsur-unsur berikut menunjukkan pola oktaf:
- Lithium (Li) memiliki nomor atom 3.
- Beryllium (Be) memiliki nomor atom 4.
- Boron (B) memiliki nomor atom 5.
- Carbon (C) memiliki nomor atom 6.
- Nitrogen (N) memiliki nomor atom 7.
- Oxygen (O) memiliki nomor atom 8.
- Fluorine (F) memiliki nomor atom 9.
Dalam contoh ini, unsur-unsur ini memiliki perubahan sifat yang teratur saat nomor atomnya meningkat satu per satu, dan demikianlah Hukum Oktaf Newlands diilustrasikan.
Kekurangan Hukum Oktaf Newlands
Hukum Oktaf Newlands memiliki beberapa kekurangan signifikan:
1. Tidak Berlaku untuk Semua Unsur
Hukum Oktaf Newlands hanya berlaku untuk unsur-unsur ringan. Saat unsur-unsur yang lebih berat dimasukkan ke dalam pengamatan, pola oktaf tidak lagi berlaku, sehingga tidak memberikan gambaran lengkap tentang seluruh Tabel Periodik.
2. Pengabaian Gas Mulia
Hukum Oktaf Newlands tidak memasukkan unsur-unsur gas mulia (kelompok VIIIA) ke dalam perhitungan, karena unsur-unsur ini belum ditemukan pada saat itu.
3. Pengurutan Berdasarkan Nomor Atom
Hukum Oktaf Newlands mengurutkan unsur-unsur berdasarkan kenaikan nomor atom, tetapi saat itu belum ada metode yang benar-benar akurat untuk menentukan massa atom atau nomor atom. Oleh karena itu, urutan unsur sering kali salah.
Kesalahan-kesalahan ini akhirnya mengakibatkan penolakan terhadap Hukum Oktaf Newlands. Pengembangan selanjutnya dalam pengelompokan unsur, seperti Tabel Periodik Mendeleev dan Tabel Periodik Modern, mengatasi kekurangan-kekurangan ini dan memberikan pendekatan yang lebih komprehensif dan akurat dalam menggambarkan sifat-sifat unsur.
4. Hukum Mendeleyev dan Tabel Periodik
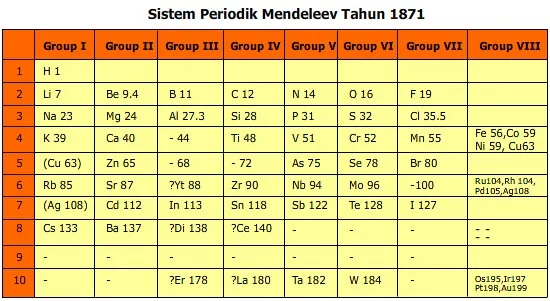
Pada tahun 1869, Dmitri Ivanovich Mendeleyev dari Rusia menyusun Tabel Periodik pertama. Dia mengamati bahwa sifat-sifat unsur berfungsi secara periodik berdasarkan massa atom relatifnya. Unsur-unsur yang memiliki sifat yang mirip ditempatkan dalam satu kolom vertikal yang disebut golongan. Tabel Periodik Mendeleyev berhasil memprediksi keberadaan unsur-unsur yang saat itu belum ditemukan, dan ramalannya kemudian terbukti benar. Namun, tabel ini memiliki kelemahan, seperti penempatan unsur yang tidak selalu sesuai dengan kenaikan massa atom relatif dan masih banyak tempat kosong dalam tabel karena banyaknya unsur yang belum dikenal.
Dalam mengelompokkan unsur-unsur, Mendeleyev lebih menekankan pada persamaan sifat unsur dibandingkan dengan kenaikan massa atom relatifnya, sehingga terdapat tempat-tempat kosong dalam tabel periodik tersebut. Tempat-tempat kosong ini yang kemudian diramalkan akan diisi unsur-unsur yang waktu itu belum ditemukan. Di kemudian hari ramalan itu terbukti dengan ditemukannya unsur-unsur yang mempunyai sifatsifat yang mirip sesuai ramalannya.
Kelemahan Tabel Periodik Mendeleyev
a. Penempatan unsur yang tidak sesuai dengan kenaikan massa atom relatifnya karena mempertahankan kemiripan sifat unsur dalam satu golongannya.
b. Masih banyak unsur yang belum dikenal pada masa itu sehingga dalam tabel terdapat banyak tempat kosong.
5. Tabel Periodik Modern
Pada tahun 1914, Henry G. J. Moseley mengemukakan penemuan penting bahwa urutan unsur dalam Tabel Periodik sesuai dengan nomor atom. Ini menghasilkan Tabel Periodik Modern atau Tabel Periodik Bentuk Panjang yang menggantikan Tabel Periodik Mendeleyev. Tabel Periodik Modern disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Tabel ini terdiri dari 18 golongan vertikal dan 7 periode horizontal. Golongan-golongan utama mencakup alkali, alkali tanah, nitrogen, kalkogen, halogen, dan gas mulia. Golongan transisi terdiri dari beberapa sub-golongan. Tabel Periodik Modern lebih akurat dan komprehensif daripada pendahulunya dan merupakan landasan utama dalam memahami sifat dan reaktivitas unsur-unsur.
Tabel periodik bentuk panjang terdiri atas lajur vertikal (golongan) yang disusun menurut kemiripan sifat dan lajur horizontal (periode) yang disusun berdasarkan kenaikan nomor atomnya.
a. Lajur vertikal (golongan)
Laju vertikal atau yang disebut golongan ditulis dengan menggunakan angka Romawi yang terdiri atas 18 golongan.
1) Golongan A (Golongan Utama)
- IA : Alkali
- IIA : Alkali Tanah
- IIIA : Aluminium
- IVA: Karbon
- VA : Nitrogen
- VIA : Kalkogen
- VIIA : Halogen
- VIIIA : Gas Mulia
2) Golongan Transisi/Golongan Tambahan (Golongan B)
Golongan transisi atau golongan tambahan terbagi atas:
- a) Golongan Transisi (Gol. B), yaitu : IIIB, IVB, VB, VIB, VIIB, VIIIB (VIII), IB, dan IIB.
- b) Golongan Transisi Dalam, ada dua deret yaitu : (1) Deret Lantanida (unsur dalam deret ini mempunyai kemiripan sifat dengan 57La). dan (2) Deret Aktinida (unsur dalam deret ini mempunyai kemiripan sifat dengan 89Ac).
Pada periode 6 golongan IIIB terdapat 14 unsur yang sangat mirip sifatnya, yaitu unsur-unsur Lantanida. Demikian juga pada periode 7 yaitu unsur-unsur Aktinida. Supaya tabel tidak terlalu panjang, unsur-unsur tersebut ditempatkan tersendiri pada bagian bawah sistem periodik.
Golongan B terletak di antara Golongan IIA dan IIIA. Unsur-unsur yang berada dalam satu golongan mempunyai persamaan sifat karena mempunyai elektron valensi (elektron di kulit terluar) yang sama.
b. Lajur Horizontal (Periode)
Laju Hirizontal atau yang bisa kita sebut sebagai priode ditulis dengan angka Arab terdiri atas 7 periode.
- Periode 1 berisi 2 unsur.
- Periode 2 berisi 8 unsur.
- Periode 3 berisi 8 unsur.
- Periode 4 berisi 18 unsur.
- Periode 5 berisi 18 unsur.
- Periode 6 berisi 32 unsur.
- Periode 7 berisi 23 unsur (belum lengkap).
Kesimpulan
Pengelompokan unsur dalam Tabel Periodik telah mengalami evolusi yang signifikan dari pengelompokan awal berdasarkan logam dan non-logam hingga Tabel Periodik Modern yang disusun berdasarkan nomor atom dan kemiripan sifat. Sejarah pengelompokan ini mencerminkan perkembangan ilmu kimia dan pemahaman kita tentang unsur-unsur. Tabel Periodik Modern adalah alat yang sangat berguna dalam memahami sifat-sifat unsur dan memprediksi perilaku kimia mereka, dan masih menjadi dasar dalam penelitian kimia hingga hari ini.